M.D.
numero 36, 29 novembre 2006
Farmaci
Terapia delle infezioni da virus erpetici:
focus su famciclovir
di
Nicoletta Cassano e Gino Antonio Vena - Clinica Dermatologica
II, Università degli Studi di Bari
Famciclovir - profarmaco di penciclovir - presenta un’azione
rapida e mirata nel bloccare la replicazione virale. Il favorevole
profilo di tollerabilità ne rende sicuro l’impiego
in popolazioni di pazienti particolari,
come anziani in politerapia e immunocompromessi
Le
molecole disponibili per il trattamento delle infezioni da virus
erpetici di maggiore interesse dermatologico (virus Varicella
zoster - VZV, e virus Herpes simplex - HSV di tipo I e II) sono
aciclovir, valaciclovir (profarmaco di aciclovir), famciclovir
(profarmaco di penciclovir) e brivudin. Tutti i farmaci sono
attivi sui tre virus erpetici, ad eccezione di brivudin, il
cui spettro di attività è rivolto contro VZV e
HSV-1, anche se il farmaco è registrato soltanto per
il trattamento dell’Herpes zoster.
In questa breve revisione sarà focalizzata l’attenzione
sui rilievi farmaco-terapeutici salienti di famciclovir, valutando
eventuali differenze con gli altri antivirali.
Impiego clinico
La riattivazione del VZV, responsabile dell’Herpes zoster,
si verifica in circa il 20% della popolazione generale nell’arco
della propria esistenza. Il rischio aumenta con l’aumentare
dell’età del soggetto: in oltre la metà dei
casi, infatti, risulta interessata la fascia di età compresa
tra 50 e 70 anni. Altri fattori implicati nell’insorgenza
dell’Herpes zoster sono rappresentati da stress psico-fisici,
neoplasie (soprattutto linforeticolari), immunosoppressione
iatrogena e immunodepressione.
Una caratteristica clinica rilevante dell’Herpes zoster
è rappresentata dal dolore, che ha un decorso piuttosto
imprevedibile. In molti casi il dolore regredisce parallelamente
alla guarigione del rash o poco dopo, mentre in altri casi la
fase acuta può cedere il passo a una forma cronica di
nevralgia post-erpetica (NPE). Anche il rischio di NPE e di
dolore più duraturo e intrattabile aumenta con l’età.
Vengono riconosciuti altri fattori di rischio di NPE, quali
severità del dolore prodromico e del dolore associato
al rash, estensione del rash, sesso femminile e localizzazione
oftalmica.
Gli studi sull’Herpes zoster sottolineano l’importanza
di un intervento precoce con antivirali non soltanto per limitare
il danno acuto, la disseminazione, la contagiosità
e le complicanze, ma anche per fare fronte al dolore e alla
NPE, con un rilevante vantaggio in termini di rapporto costo/beneficio,
tenuto anche conto del fatto che la gestione della NPE è
complessa e non di rado frustrante.
Famciclovir è registrato per il trattamento dell’Herpes
zoster al dosaggio di 250 mg per tre volte al dì (3/die)
per 7 giorni, con la possibilità di raddoppiare la dose
a 500 mg 3/die per 7 giorni in caso di Herpes oftalmico e
nei soggetti a rischio di NPE e per 10 giorni negli immunocompromessi.
L’analisi degli studi clinici testimonia il positivo impatto
di famciclovir sull’Herpes zoster acuto e sulla NPE. Questi
risultati evidenziano inoltre che il controllo della sintomatologia
dolorosa si determina più rapidamente con la dose di
500 mg 3/die e che l’effetto sulla risoluzione della
NPE è ancora più positivo nei pazienti con più
di 50 anni, notoriamente più a rischio.
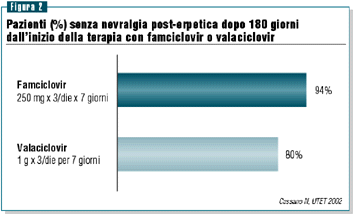
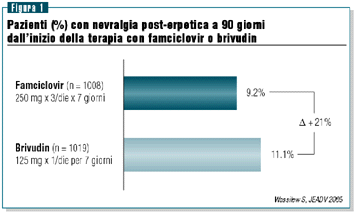 Inoltre,
dati indiretti sembrano suggerire alcune differenze a favore
di famciclovir rispetto ad altre molecole in termini di miglioramento
della NPE (figure 1 e 2).
Inoltre,
dati indiretti sembrano suggerire alcune differenze a favore
di famciclovir rispetto ad altre molecole in termini di miglioramento
della NPE (figure 1 e 2).
Per quanto concerne l’Herpes genitale, famciclovir è
attivo sia nel trattamento dell’infezione primaria e ricorrente
sia nella soppressione delle recidive dell’immunocompetente
e dell’immunocompromesso. La terapia soppressiva, fondamentale
per la gestione di pazienti con un numero frequente di recidive,
impedisce la trasmissione del virus anche in soggetti asintomatici.
Un recente studio ha posto in rilievo la superiorità
rispetto al placebo nell’Herpes genitale recidivante di
uno schema posologico alternativo di famciclovir, somministrato
alla dose di 1000 mg 2/die per un solo giorno. Questo schema,
al momento ‘off-label’, risulterebbe vantaggioso nel
migliorare la compliance dei pazienti al trattamento.
 Considerando
altre possibilità di impiego ‘off-label’ di
famciclovir, un recente studio controllato ha dimostrato l’utilità
di 1500 mg in singola dose o in due dosi da 750 mg per un solo
giorno, entro un’ora dalla comparsa dei sintomi, nel trattamento
delle recidive di Herpes labiale. Vari schemi posologici si
sono dimostrati utili nella profilassi dell’infezione da
HSV dopo procedure di laser resurfacing.
Considerando
altre possibilità di impiego ‘off-label’ di
famciclovir, un recente studio controllato ha dimostrato l’utilità
di 1500 mg in singola dose o in due dosi da 750 mg per un solo
giorno, entro un’ora dalla comparsa dei sintomi, nel trattamento
delle recidive di Herpes labiale. Vari schemi posologici si
sono dimostrati utili nella profilassi dell’infezione da
HSV dopo procedure di laser resurfacing.
Farmacocinetica e meccanismo d’azione
La molecola di famciclovir è molto stabile nel tratto
gastroenterico e subisce un rapido e completo assorbimento,
che appare prevedibile e non modificato dai pasti; la biodisponibilità
è costante e molto ampio è il volume di distribuzione
tissutale. Già questi aspetti mettono in luce le prime
differenze con gli altri analoghi nucleosidici, dal momento
che l’assorbimento di aciclovir manca di prevedibilità,
e quello di valaciclovir è dose-dipendente, suscettibile
di saturazione e influenzabile da ioni organici. Inoltre, la
stabilità di valaciclovir nel lume gastroenterico potrebbe
risentire delle variazioni del pH. Famciclovir viene convertito
rapidamente e pressoché completamente in penciclovir.
La biodisponibilità di penciclovir derivato da famciclovir
è di circa il 77%, piuttosto alta se la si confronta
con quella di aciclovir derivata da aciclovir come tale (10-20%)
e anche dal suo profarmaco valaciclovir (54%).
Il meccanismo d’azione degli analoghi della guanosina,
aciclovir e penciclovir, condivide aspetti comuni, coinvolgendo
gli stessi target molecolari virali: timidina-chinasi e DNA-polimerasi.
L’azione dei farmaci ha luogo unicamente in cellule infette,
in quanto prevede l’attivazione preliminare specifica da
parte della timidina-chinasi virale e non comporta tossicità
nei confronti di cellule in attiva replicazione non soggette
a infezione. L’attività antivirale consegue all’incorporazione
dei composti attivi (trifosfato) nel DNA del virus a opera della
DNA-polimerasi virale. Esistono tuttavia delle differenze tra
aciclovir e penciclovir. In primo luogo, l’affinità
maggiore di penciclovir per la timidina-chinasi si traduce in
una conversione facilitata nella forma attiva, rapida (in circa
un minuto) e stabile nel tempo, a differenza di aciclovir-trifosfato,
che si forma invece dopo circa 1 ora e subisce una drastica
riduzione dopo il raggiungimento del picco.
Di contro, la maggiore affinità di aciclovir-trifosfato
nei confronti della DNA-polimerasi virale potrebbe giustificare
il rapido consumo intracellulare di aciclovir-trifosfato la
cui attività, tra l’altro, declina con la caduta
dei livelli plasmatici, mentre l’attività di penciclovir-trifosfato
a livello intracellulare è persistente in maniera indipendente
dai livelli plasmatici.
Tutti questi presupposti si traducono in profonde differenze
nell’emivita intracellulare, che risulta per penciclovir
di circa 7-11 ore in cellule infettate da VZV, 10 ore in cellule
infettate da HSV-1 e 20 ore in cellule infettate da HSV-2, mentre
è al massimo di 1 ora in cellule infettate da VZV, HSV-1
e HSV-2 per aciclovir (e quindi anche valaciclovir). Alcuni
dati interessanti possono essere desunti da studi su modelli
animali, che hanno mostrato l’effetto più rapido,
completo e duraturo di famciclovir rispetto a valaciclovir,
anche in condizioni di immunodepressione o in caso di somministrazione
ritardata.
Un ulteriore dato di rilievo, non condiviso da aciclovir, è
la capacità di penciclovir di indurre apoptosi in vitro
nelle cellule infette, che potrebbe essere almeno in parte
responsabile della maggiore attività nei modelli animali.
L’induzione della morte programmata delle cellule
infette potrebbe, infatti, favorire la delimitazione del focolaio
d’infezione e la persistenza di un’attività
replicativa residua.
Per quanto riguarda brivudin, una differenza sostanziale rispetto
agli altri antivirali è che esso è un analogo
della timidina, fatto che giustifica le interazioni con il 5-fluorouracile
o altri derivati pirimidinici, a differenza degli analoghi della
guanosina, come riportato in tabella 1.
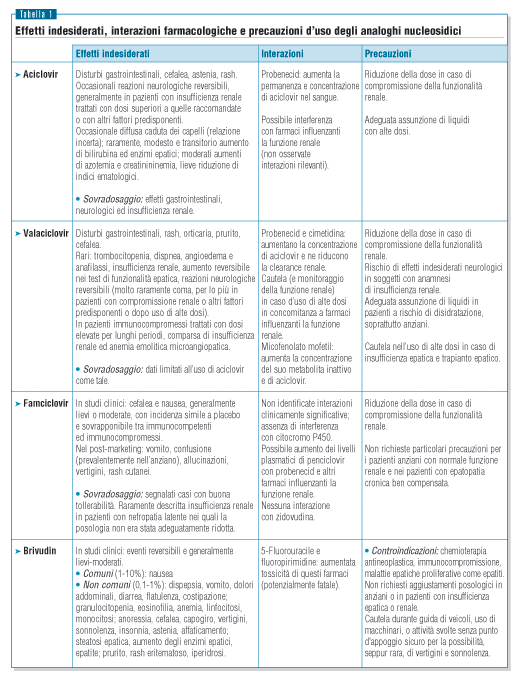
Profilo di tollerabilità
La tollerabilità di famciclovir è molto buona,
paragonabile a quella del placebo negli studi clinici.
L’indipendenza dell’enzima responsabile dell’ossidazione
di famciclovir dal citocromo P450 giustifica l’assenza
di interazioni con i numerosi farmaci metabolizzati tramite
questa via. Il profilo di tollerabilità viene pertanto
preservato anche in pazienti sottoposti a politerapia, inclusi
gli immunocompromessi. Come per gli altri analoghi della guanosina,
si deve considerare la possibile riduzione della clearance da
parte di farmaci escreti per via renale, come probenecid.
Rispetto alle interazioni farmacologiche riportate nelle schede
tecniche degli antivirali, non sono emerse ulteriori novità
a parte la possibilità che l’interazione tra micofenolato
mofetil e valaciclovir sia probabilmente in grado di indurre
effetti clinicamente rilevanti, come suggerito dalla descrizione
di un caso di neutropenia verosimilmente correlata all’assunzione
contemporanea dei due farmaci.
Un’epatopatia cronica ben compensata non richiede cambiamenti
nella dose di famciclovir, come dimostrano valutazioni effettuate
in soggetti con epatite cronica, alcolismo cronico e cirrosi
biliare primitiva. D’altra parte, i numerosi studi con
famciclovir in soggetti con epatite HBV-correlata sono un’indiretta
conferma della tollerabilità in corso di epatopatia.
Di contro, sono necessari aggiustamenti posologici in caso di
insufficienza renale, come accade per gli altri analoghi della
guanosina. A questo proposito si stanno accumulando sempre più
segnalazioni legate alla neurotossicità di aciclovir
o valaciclovir prevalentemente in pazienti con insufficienza
renale.
Alcuni autori ritengono che la neurotossicità indotta
da aciclovir in corso di insufficienza renale sia imprevedibile
e possa verificarsi anche con bassi dosaggi.
Nella tabella 1 sono riassunte informazioni sul profilo di tollerabilità
degli analoghi nucleosidici.
In conclusione, considerando l’insieme dei dati finora
disponibili, il profilo di tollerabilità di famciclovir
rimane favorevole, cosa che rende il farmaco ancora più
sicuro in popolazioni di pazienti particolari, come gli anziani
e gli immunocompromessi, inclusi i pazienti HIV-positivi.