M.D.
numero 37, 6 dicembre 2006
Rassegna
Cause e gestione del sanguinamento in corso
di terapia ormonale sostitutiva
di Lino Del Pup - Oncologia Chirurgica
Ginecologica, Istituto Nazionale Tumori, Aviano (PN)
Solo in un terzo dei casi di perdite ematiche atipiche durante
l’uso dell’HRT sono presenti patologie organiche.
Il mancato riscontro di una patologia non deve però
fare interrompere l’approfondimento diagnostico, soprattutto
tentando di ottenere una migliore compliance dalle pazienti,
in quanto in maggioranza interromperanno il trattamento preoccupate
dai sanguinamenti
Il
38% delle donne che usano la terapia ormonale sostitutiva (HRT)
sequenziale e il 41.6% di coloro che assumono l’HRT combinata
fanno almeno una visita ginecologica a causa di perdite ematiche
inattese.
Rispettivamente più del 12% e del 20% di esse vengono
sottoposte a una o più procedure invasive a causa del
bleeding causato dalla terapia ormonale sostitutiva1 nel timore
di patologie neoplastiche. Eppure nel più ampio trial
randomizzato sull’HRT, lo studio WHI,2
il rischio relativo di carcinoma endometriale è addirittura
tendenzialmente ridotto rispetto a chi non utilizza terapie
ormonali (RR=0.83). Solo nel 27% dei casi di perdite ematiche
atipiche durante l’uso della terapia sostitutiva vi sono
infatti patologie organiche, quasi sempre benigne e raramente
maligne,3 mentre nel 73% circa dei casi
le indagini ginecologiche non rilevano alcuna causa macroscopicamente
identificabile.
 In
questi casi va ipotizzato che si tratti di cause “non visibili”
come la presenza di un endometrio “fragile”, di disturbi
della coagulazione, di asincronia tra la steroidogenesi endogena
e l’HRT, scarsa compliance alla terapia, inadeguato assorbimento
o interazioni farmacologiche4 (tabella 1).
In
questi casi va ipotizzato che si tratti di cause “non visibili”
come la presenza di un endometrio “fragile”, di disturbi
della coagulazione, di asincronia tra la steroidogenesi endogena
e l’HRT, scarsa compliance alla terapia, inadeguato assorbimento
o interazioni farmacologiche4 (tabella 1).
Il mancato riscontro di una patologia organica non deve fare
quindi interrompere l’approfondimento diagnostico dicendo
alla paziente, spaventata, che non ha nulla. Certo, circa tre
quarti delle pazienti in HRT non presentano patologie ginecologiche,
ma in maggioranza interromperanno il trattamento preoccupate
di sanguinamenti quasi sempre innocui e quindi risolvibili personalizzando
meglio gli schemi di HRT o tentando di ottenere una migliore
compliance informandole e rassicurandole.5
Patologie organiche ginecologiche
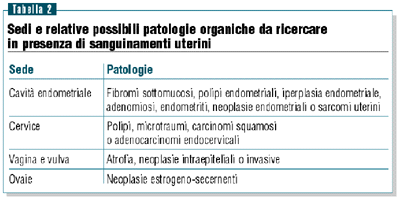 Le
cause organiche ginecologiche di bleeding vanno sospettate
in ogni caso e le più frequenti sono fibromi sottomucosi,
polipi e iperplasia endometriale.
Le
cause organiche ginecologiche di bleeding vanno sospettate
in ogni caso e le più frequenti sono fibromi sottomucosi,
polipi e iperplasia endometriale.
Le cause cervicali sono maggiormente probabili nei casi in cui
la perdita avvenga dopo il coito. L’adenomiosi è
più frequente di quanto clinicamente e strumentalmente
sospettabile, e la diagnosi è in genere solo anatomo-patologica
(tabella 2).
Una volta riscontrata una potenziale causa bisogna proseguire
sistematicamente la valutazione di tutte le altre, dato che
queste possono coesistere.
Questo approccio è particolarmente importante quando
l’entità del fattore causale di primo riscontro
non sembra motivare interamente il bleeding.
Endometrio “fragile”
Le perdite ematiche possono essere dovute a fattori locali che
determinano una particolare “fragilità” dell’endometrio
in assenza di patologie organiche, ginecologiche benigne o neoplastiche.
I trattamenti combinati continui, per esempio, causano la formazione
di un endometrio istologicamente anomalo, dovuto all’uso
continuativo del progestinico, caratterizzato da una particolare
fragilità dello stroma e dei vasi del microcircolo, con
anomalie delle cellule endoteliali che sono meno numerose
e più disperse e dei periciti.6
Questa è di gran lunga la principale causa di bleeding
in corso di trattamenti combinati continui, non visibile ecograficamente,
sospettabile isteroscopicamente e confermabile solo istologicamente.
Il meccanismo biochimico che determina l’eccessiva fragilità
strutturale dell’endometrio può coinvolgere le metallo-proteinasi
(matrix metalloproteinases o MMPs), una famiglia di enzimi attivamente
coinvolti nel rimodellamento endometriale, che degradano la
matrice extracellulare. Esse sono secrete come premetallo proteinasi
inattive e sono attivate o meno a livello endometriale in base
al rapporto relativo con i propri inibitori detti TIMPs (Tissue
Inhibitors o MMPs).
Il meccanismo di controllo delle MMPs è complesso e vi
sono coinvolti diversi tipi di cellule (mast cells, eosinofili,
neutrofili e cellule stromali), attivatori locali (attivatori
del plasminogeno, kallicreina, catepsina B), mediatori paracrini
(interleukina-1 beta, transforming growth factor-beta, tumor
necrosis factor-alfa) e fattori bloccanti (beta-2 macroglobulina
e TIMPs).
Sono state documentate alterazioni di questi mediatori locali
con conseguenti bleeding, in modo particolare nei primi mesi
di assunzione della terapia ormonale sostitutiva.7
Una volta che appropriate indagini hanno escluso la presenza
di patologie organiche, le donne che hanno sanguinamenti probabilmente
legati a un endometrio “fragile” possono essere rassicurate
soprattutto se tali sanguinamenti sono presenti nei primi mesi
di assunzione, dato che hanno un rischio endometriale statisticamente
ridotto, anche rispetto a chi non usa HRT.
Non vi sono indagini in grado di valutare attendibilmente i
fattori locali che causano un eccessivo sfaldamento endometriale
e mancano terapie eziopatogenetiche.
Il trattamento consiste nel rassicurare o nel tentare di cambiare
terapia modificando la potenza relativa di estrogeno e progestinico
o il tipo di farmaci.
Disturbi della coagulazione
Il sanguinamento endometriale può essere l’unico
segno di una anomalia della coagulazione non ancora diagnosticata.
I disturbi della coagulazione possono essere dovuti a cause
congenite, come la malattia di von Willebrand, all’uso
di farmaci antiaggreganti piastrinici o anticoagulanti o a patologie
ematologiche, come per esempio le leucemie. Il trattamento
dipende dalle cause e va condiviso con lo specialista ematologo
o oncoematologo.
Asincronia con la steroidogenesi endogena
Nel periodo perimenopausale, anche in assenza di mestruazioni,
nelle donne non ovariectomizzate vi è ancora un’attività
steroidogenica ovarica, in genere variabile e a volte con potenziali
sporadici cicli ovulatori.
Gli schemi sequenziali sono i più adeguati a mimare un
ciclo naturale e sono di prima scelta. Le combinazioni fisse
e di schemi posologici standard con l’aggiunta del progestinico
in fase luteale si riferiscono a un ciclo “ideale”
di 28 giorni con ovulazione verso il 14° giorno.
Le pazienti possono però avere due mestruazioni al mese,
quella indotta dalla terapia e quella spontanea imprevedibile,
sfasata, dovuta a ovulazioni o variazioni in calo della steroidogenesi
endogena. In questi casi si può tentare di personalizzare
il periodo di assunzione del progestinico, sincronizzandolo
con l’ipotetica fase luteale, per esempio assumendo un
progestinico da 14 a 2 giorni prima delle presunta periodica
scadenza mestruale. Il grosso limite all’efficacia di questa
strategia è legato alla notevole variabilità dei
cicli in perimenopausa.
L’uso di contraccettivi ormonali combinati permette di
bloccare eventuali ovulazioni, proteggere da poco probabili
gravidanze indesiderate, ma soprattutto di avere un controllo
del ciclo migliore dell’HRT.
Va però esclusa la presenza di controindicazioni, ricordando
che la potenza estroprogestinica dei contraccettivi è
in genere molto maggiore di quella dell’HRT e, quando si
ritiene cessata la steroidogenesi autonoma, la paziente va convertita
in HRT, se ne ha ancora le indicazioni.
Scarsa compliance all’HRT
Bisogna valutare sempre l’ipotesi che l’HRT non venga
utilizzata correttamente, chiedendo esplicitamente alla donna
quali sono le modalità di assunzione.
Gli studi sulla compliance indicano che il medico non deve sempre
dare per scontato che le pazienti assumano il trattamento come
prescritto. L’uso inadeguato di tutti i farmaci è
infatti frequente, molto di più di quanto percepisca
il medico, in quanto l’assunzione irregolare, ridotta ed
eseguita con modalità dettate da criteri soggettivi viene
in genere negata.8,9
Per l’HRT questo è un aspetto rilevante, spesso
trascurato nell’anamnesi e particolarmente critico, in
quanto ha come possibile conseguenza l’incremento del rischio
di iperplasia e cancro endometriale fino a 15 anni dopo la sospensione.10
Infatti è proprio il progestinico a essere in genere
“autoridotto”, in quanto può causare fastidiosi
effetti collaterali e la sua riduzione non determina un significativo
accentuarsi dei sintomi climaterici.
In pratica la paziente a volte scopre che saltando in parte
o del tutto l’assunzione del progestinico si sente meno
gonfia o con meno sintomi fastidiosi dal punto di vista psichico.
La lettura del foglietto illustrativo dei progestinici induce
a ridurre l’uso di questo componente fondamentale, con
la conseguente inadeguata protezione endometriale: come per
tutti i farmaci vi sono ampiamente descritti tutti i potenziali
rischi, ma è solo il medico che deve informare sul rischio
di cancro endometriale derivante dal mancato o parziale utilizzo.
Le principali strategie di gestione di questo aspetto sono l’informazione
adeguata collegata all’impostazione del rapporto medico-paziente
basato sulla fiducia: solo se la paziente ha un alto livello
di fiducia dà un peso minore alle notizie contrastanti
e allarmanti sull’uso della terapia ormonale sostitutiva
che riceve da fonti alternative.11
Sono comunque preferibili gli estroprogestinici che contengono
estrogeno e progestinico negli stessi confetti, a dosi fisse
adeguatamente protettive per l’endometrio, non modificabili
da parte della paziente e strutturate in modo da rendere difficili
gli errori di assunzione.12 I sistemi transdermici contenenti
anche il progestinico hanno importanti vantaggi per la compliance
evitando gli effetti legati alla somministrazione orale e impedendo
fisicamente di ridurre o omettere l’assunzione del progestinico.
Quando non vi sono prodotti con associazioni fisse soddisfacenti
la personalizzazione degli schemi posologici effettuata da medico
e basata sulla risposta clinica della paziente è fondamentale
per fare in modo che la paziente abbia il massimo beneficio
sintomatico e quindi prosegua la terapia seguendo schemi protettivi
per l’endometrio.
Inadeguato assorbimento
Le patologiemo gastroenterologiche che determinano un malassorbimento,
talvolta misconosciute, come per esempio il morbono celiaco,
possono impedire l’adeguato assorbimento degli estroprogestinici
e causare bleeding.
In questi casi le somministrazioni transdermiche o comunque
non orali di estrogeno e progestinico, meglio se associati nello
stesso prodotto, forniscono le migliori garanzie di protezione
endometriale. Accanto a questo lo specialista gastroenterologo
può aiutarci a individuare e trattare o escludere tali
patologie.
Interazioni farmacologiche
Nel considerare tutte le possibili cause del bleeding in corso
di HRT non va dimenticato di indagare sull’uso di farmaci
concomitanti.
In particolare è utile chiedere se è in corso
oppure se sono stati utilizzati antibiotici o altri farmaci,
come per esempio gli induttori enzimatici.
Nello specifico, se vengono utilizzati gli antibiotici ad ampio
spettro, questi possono alterare la flora intestinale e quindi
l’assorbimento degli estroprogestinici orali.
I farmaci induttori enzimatici possono influenzare il metabolismo
estrogenico. L’uso di impianti sottocutanei è attualmente
rarissimo in Italia, ma va considerato che possono mantenere
la loro attività endocrina anche anni dopo l’inserzione.13
In questi casi è prudente dare un progestinico mensile
in fase luteale fino a quando per tre cicli consecutivi non
vi sia amenorrea.
Va ricordato che l’uso concomitante di tamoxifene potrebbe
essere una causa di bleeding in corso di terapia ormonale sostitutiva.4
Bibliografia
1. Ettinger B et al. Unexpected vaginal bleeding
and associated gynecologic care in postmenopausal women using
hormone replacement therapy: comparison of cyclic versus continuous
combined schedules. Fertil Steril 1998; 69: 865–9.
2. Wrighting group for the WHI investigators. Risks and benefits
of estrogen plus progestin in healthy postmenopausal women:
prinicipal results from the Women’s Health Initiative randomised
controlled trial. JAMA 2002; 288: 321-33.
3. Akkad A et al. Abnormal bleeding on hormone replacement:
the importance of intrauterine structural abnormalities. Obstet
Gynecol 1995; 86: 330-4.
4. Spencer CP et al. Fortnightly review: management of abnormal
bleeding in women receiving hormone replacement therapy. BMJ
1997; 315: 37-42.
5. Del Pup L et al. La compliance all’HRT. Motivazioni
e suggerimenti. Ed. Novartis 2000.
6. Hickey M et al. Changes in endometrial blood vessels in the
endometrium of women with hormone replacement therapy-related
irregular bleeding. Hum Reprod 2003; 18: 1100-06.
7. Hickey M et al. Endometrial bleeding in hormone replacement
therapy users: preliminary findings regarding the role of matrix
metalloproteinase 9 (MMP-9) and tissue inhibitors of MMPs. Fertil
Steril 2001; 75: 288-96.
8. Del Pup L et al. La compliance all’HRT: analisi dei
motivi dell’insuccesso dell’assunzione terapeutica
nelle donne italiane. Menopausa. CIC Ed, Roma 1999.
9. Del Pup L et al. Gestire gli effetti collaterali dell’HRT.
Terapie omonali in ginecologia. CIC Ed,
Roma 2000.
10. Paganini-Hill A et al. Endometrial cancer and patterns of
use of oestrogen replacement therapy:
a cohort study. Br J Cancer 1989; 59: 445-7.
11. Del Pup L. Strategie per migliorare la compliance all’HRT.
Congresso SIM 2003. CIC Ed,
Roma 2003.
12. Del Pup L. Estradiolo con nomegestrolo acetato: un modello
originale di terapia ormonale. Contraccezione, Fertilità,
Sessualità 2005; 13: 7-18.
13. Gangar K et al. Symptoms of oestrogen deficiency associated
with supraphysiological plasma oestradiol concentrations in
women with oestradiol implants. BMJ 1989; 299: 601-2.