M.D.
numero 9, 21 marzo 2007
Clinica
Carcinoma differenziato della tiroide: diagnosi,
terapia e follow-up
di Furio Pacini, Lucia Brilli, Maria Grazia Castagna -
Sezione di Endocrinologia e Malattie Metaboliche, Università
di Siena
Negli ultimi anni si è registrato un aumento dell’incidenza
del carcinoma tiroideo, nella maggior parte dei casi papillare.
Tale incremento è dovuto anche all’affinamento delle
tecniche diagnostiche, anche se va escluso l’effetto di
condizioni ambientali. Nonostante ciò la mortalità
appare in decremento, in conseguenza di diagnosi
sempre più precoci e di programmi terapeutici multidisciplinari.
L’articolo che segue fa il punto sulle più recenti
indicazioni diagnostiche e terapeutiche
Il
cancro della tiroide rappresenta l’1-2% di tutte
le neoplasie maligne dell’adulto.
Il dato più rilevante emerso negli ultimi anni è
il progressivo aumento dei casi di tumore della tiroide,
in tutte le fasce d’età, con una netta prevalenza
dell’istotipo papillare (circa 80% dei casi di tumore
tiroideo).
Questi dati riguardano le casistiche americane dove è
stata infatti stimata nel 2002 un’incidenza di tumore della
tiroide di 8.7 casi su 100.000 abitanti per anno contro i 3.6
casi su 100.000 abitanti per anno nel 19731.
L’aumentata incidenza del carcinoma differenziato della
tiroide (CTD) è da correlarsi al miglioramento delle
tecniche diagnostiche e, in particolare, dal routinario
impiego dell’ecografia tiroidea.
Non è tuttavia possibile escludere l’effetto di
condizioni ambientali quali l’esposizione ad agenti cancerogeni,
maggiormente presenti in determinate aree geografiche (quali
quelle vulcaniche), o a radiazioni ionizzanti.
Nonostante l’aumentata incidenza, la mortalità
appare invece in netto decremento in conseguenza di diagnosi
sempre più precoci e di programmi terapeutici multidisciplinari.
Il tumore della tiroide si manifesta clinicamente come nodulo
tiroideo, nella maggior parte dei casi scoperto nel corso
di una ecografia del collo.
La patologia nodulare tiroidea rappresenta l’endocrinopatia
più frequente e noduli tiroidei si riscontrano in circa
il 50% delle donne d’età superiore ai 50 anni2.
Tuttavia soltanto meno del 5% è in realtà un
tumore maligno.
È quindi fondamentale la distinzione tra noduli benigni
e noduli maligni.
Diagnosi
La storia clinica del paziente rappresenta il primo approccio
al problema. La storia di una precedente irradiazione del collo
durante l’infanzia, la familiarità per carcinoma
della tiroide, la rapida crescita del nodulo orientano
verso il sospetto di malignità.
L’esame obiettivo del collo riveste la massima importanza
nella valutazione diagnostica. Una corretta palpazione della
tiroide permette di accertare il carattere unico e multiplo,
le dimensioni e la consistenza del nodulo e l’eventuale
presenza di linfoadenopatie latero-cervicali, di frequente
riscontro nel caso di tumori maligni della tiroide.
Il passo successivo è l’ecografia del collo associata
alla misurazione dei livelli di TSH, di FT3 e FT4, per escludere
una sottostante tireopatia (ipo- o ipertiroidismo) e il dosaggio
della calcitonina (CT), marker essenziale nella diagnosi preoperatoria
del carcinoma midollare, una forma rara di carcinoma tiroideo,
con un’accuratezza diagnostica superiore all’esame
citologico3.
Il dosaggio della tireoglobulina (Tg) non ha un ruolo nella
diagnostica dei noduli tiroidei dal momento che è
correlata alle dimensioni della tiroide piuttosto che alla natura
del nodulo stesso4.
L’ecografia tiroidea con ecocolordoppler è fondamentale
nella diagnostica dei noduli tiroidei ed è sempre più
utilizzata come primo esame diagnostico. Aspetti ecografici
suggestivi di malignità sono rappresentati dall’ipoecogenicità
del nodulo, dalla presenza di calcificazioni, dall’assenza
di alone periferico, dai margini irregolari e dalla vascolarizzazione
intranodulare. La combinazione di questi caratteri ultrasonografici
ha un elevato valore predittivo di malignità5.
Sebbene l’ecografia possa orientare verso una diagnosi
di natura, il “gold standard” per distinguere tra
nodulo tiroideo benigno e maligno è rappresentato
dall’esame citologico mediante agoaspirazione con ago sottile
(FNAC)6.
Una recente consensus europea7 consiglia
di eseguire l’agoaspirato tiroideo su tutti i noduli solitari
delle dimensioni superiori a un centimetro, mentre in caso
di noduli piccoli (<1 cm) va eseguito solo in presenza
di aspetti ecografici o anamnestici suggestivi di malignità.
In caso di gozzo multinodulare va eseguito sui noduli
di maggiori dimensioni che risultano “freddi” o “ipocaptanti”
alla scintigrafia tiroidea.
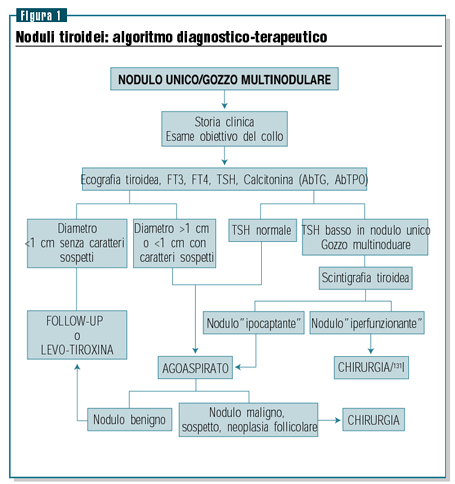
La figura 1 illustra l’algoritmo diagnostico-terapeutico
più comunemente accettato e recentemente adottato nella
consensus europea realizzata sotto l’egida dell’European
Thyroid Association7.
Trattamento iniziale
Il trattamento iniziale del carcinoma tiroideo differenziato
si basa sulla tiroidectomia totale seguita dall’ablazione
del residuo tiroideo post-chirurgico con 131I.
Terapia chirurgica
La tiroidectomia totale rappresenta il trattamento iniziale
minimo di tutti i carcinomi tiroidei, indipendentemente
dalle loro dimensioni, avendo come obiettivo la rimozione di
tutti i focolai tumorali. La dissezione linfonodale del
compartimento centrale va eseguita in tutti i pazienti con
diagnosi di carcinoma tiroideo differenziato, mentre la
linfoadenectomia latero-cervicale è indicata solo nei
casi con evidenza pre-chirurgica di coinvolgimento linfonodale.
Uno dei principali argomenti a favore di una tiroidectomia totale
è l’alta frequenza di multifocalità e bilateralità,
soprattutto nei pazienti con carcinoma papillare della
tiroide. Studi istologici hanno infatti dimostrato la presenza
di foci microscopici di carcinoma tiroideo nel lobo controlaterale
in circa il 40-50% dei pazienti con carcinoma papillare
della tiroide8.
Una tiroidectomia radicale riduce significativamente il rischio
di recidiva di malattia, facilita il trattamento ablativo
con 131I del residuo tiroideo chirurgico e il successivo follow-up9.
L’intervento chirurgico di tiroidectomia espone al rischio
di lesione del nervo ricorrente e di ipoparatiroidismo. Il
rischio, per entrambe le complicanze, è poco frequente
(<2%) quando l’intervento è eseguito da un chirurgo
esperto.
Terapia ablativa del residuo tiroideo post-chirurgico con
131I
La tiroidectomia totale è seguita dall’ablazione
del tessuto tiroideo residuo mediante 131I. Le cellule
follicolari hanno infatti la peculiarità di captare
e organificare lo iodio radioattivo. Questa proprietà,
che si esplica grazie a un meccanismo di trasporto attivo dipendente
dalla proteina di trasporto dello iodio e del sodio (NIS - Sodium
Iodine Symporter), è conservata anche in una significativa
proporzione di cellule tiroidee neoplastiche. È su
questa base che la terapia con iodio radioattivo è diventata
parte integrante del trattamento iniziale del carcinoma tiroideo
differenziato10.
Il razionale dell’ablazione del residuo tiroideo è
quello di ridurre il rischio di recidiva e di facilitare
il follow-up attraverso la distruzione del residuo tiroideo
post-chirurgico11.
L’attività di radioiodio utilizzata è, nella
maggior parte dei casi, un’attività empirica compresa
tra 30 e 100 mCi con una efficacia ablativa compresa tra il
65% e il 90%. Sebbene molti autori consiglino l’impiego
di alte attività per l’ablazione del residuo tiroideo
post-chirurgico (100 mCi), numerosi studi presenti in letteratura
dimostrano come basse attività (30-50 mCi) siano in grado
di garantire un’efficacia terapeutica sovrapponibile a
quella ottenuta con le alte dosi di 131I senza condizionare
l’outcome del paziente.12 Nella
pratica clinica generalmente si ricorre a dosi standard di 131I
comprese tra 30 e 100 mCi.
Essendo la captazione dello iodio da parte delle cellule follicolari
tiroidee dipendente dal TSH, per l’ablazione del tessuto
tiroideo residuo con 131I sono necessari elevati livelli circolanti
di questo ormone (>25 mU/l) che si possono ottenere tramite
sospensione della terapia con levo-tiroxina (4-5 settimane)
o mediante somministrazione esogena di TSH umano ricombinante
(rhTSH), una glicoproteina di sintesi in grado di stimolare
la captazione dello iodio e la produzione di tireoglobulina
da parte del tessuto tiroideo residuo e/o metastatico.13,14
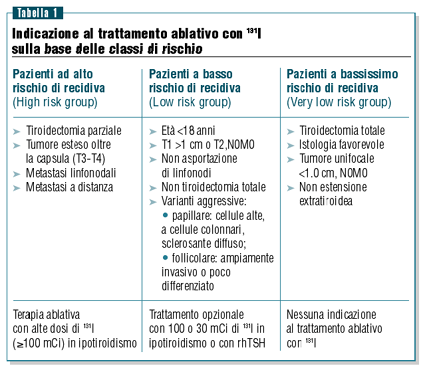 Secondo
le indicazioni riportate nella consensus europea7
il trattamento radiometabolico è sicuramente indicato
in caso di persistenza di malattia dopo il trattamento chirurgico
o in pazienti ad alto rischio di recidiva (high risk group),
mentre non c’è nessuna indicazione in caso di tumore
unifocale <1 cm, senza estensione extratiroidea (very
low risk group) (tabella 1).
Secondo
le indicazioni riportate nella consensus europea7
il trattamento radiometabolico è sicuramente indicato
in caso di persistenza di malattia dopo il trattamento chirurgico
o in pazienti ad alto rischio di recidiva (high risk group),
mentre non c’è nessuna indicazione in caso di tumore
unifocale <1 cm, senza estensione extratiroidea (very
low risk group) (tabella 1).
Follow-up del carcinoma tiroideo differenziato
Le finalità del follow-up diagnostico nel CTD sono rappresentate
dalla correzione dell’ipotiroidismo post-chirurgico e dalla
precoce individuazione di persistenza o recidiva di malattia.
Circa il 5-10% dei pazienti presenta metastasi loco-regionali
o a distanza già alla diagnosi, mentre il 5-20% di essi
li sviluppa nel corso del follow-up. Le recidive sono più
frequenti durante i primi cinque anni di follow-up, ma possono
manifestarsi anche a distanza di alcune decadi dal trattamento
iniziale, pertanto il follow-up deve essere continuato per tutta
la vita.
Il primo controllo dopo l’intervento e la terapia con 131I
si effettua dopo circa tre mesi. In questa occasione si effettua
un’ecografia del collo e il dosaggio di FT3, FT4, TSH,
Tg e AbTg allo scopo di verificare se il paziente assume una
dose corretta di levo-tiroxina e per valutare i livelli di Tg
(marcatore tumorale dotato di alta sensibilità e
specificità) durante il trattamento ormonale.
In presenza di valori indosabili di Tg e negatività degli
anticorpi anti-tiroide, a distanza di circa 6-12 mesi dal trattamento
radiometabolico con 131I verrà eseguito il dosaggio della
Tg dopo rhTSH associato all’ecografia del collo.
L’uso combinato delle due metodiche è infatti in
grado di diagnosticare tutti i pazienti con persistenza
o recidiva di malattia loco-regionale o a distanza.15
In presenza di valori indosabili di Tg (<1.0 ng/ml) e negatività
dell’ecografia del collo, il paziente potrà essere
considerato in remissione di malattia e dovrà eseguire
annualmente l’ecografia del collo e il dosaggio della tireoglobulina
durante il trattamento con ormoni tiroidei.
In presenza di tireoglobulina dosabile (>2.0 ng/ml) il paziente
dovrà essere sottoposto a un nuovo trattamento terapeutico
che a seconda del caso potrà essere rappresentato dalla
chirurgia (in presenza di metastasi linfonodali o metastasi
a distanza aggredibili chirurgicamente) o della terapia radiometabolica
con 131I.
Nei pazienti con livelli di Tg dopo rhTSH compresi tra 1-2 ng/ml
è consigliabile ripetere il dosaggio della Tg dopo rhTSH
a distanza di un anno: in presenza di Tg indosabile il paziente
potrà essere considerato in remissione di malattia; nel
caso in cui la Tg permane dosabile, ma a livelli ridotti rispetto
al controllo precedente potrà essere indicata la prosecuzione
del follow-up, mentre in caso di un ulteriore incremento dei
valori di Tg sarà necessario un completamento diagnostico
mediante TAC collo-torace e la 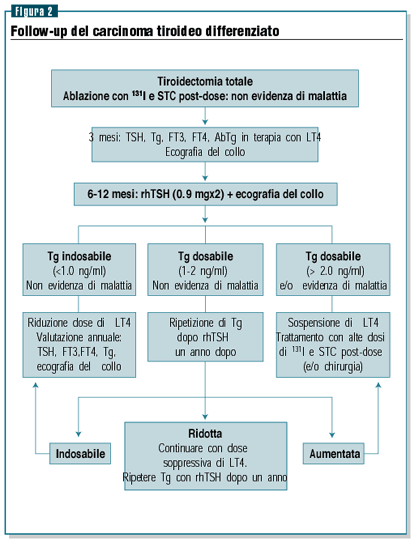 somministrazione
di un’ulteriore dose terapeutica di 131I7 (figura 2).
somministrazione
di un’ulteriore dose terapeutica di 131I7 (figura 2).
La scintigrafia totale corporea con dose diagnostica di 131I
è riservata ai pazienti con positività degli anticorpi
anti-tireoglobulina dal momento che, in questi casi, il dosaggio
della Tg non rappresenta un indicatore affidabile.
I controlli seriati degli AbTg possono essere utilizzati come
marcatore alternativo. Infatti nei pazienti con AbTg positivi
che sono stati curati si assisterà ad una progressiva
negativizzazione degli anticorpi entro 1-4 anni. Al contrario,
pazienti che presenta una persistenza di malattia dopo il trattamento
hanno sempre valori dosabili degli AbTg.16
Terapia delle metastasi
La cura delle metastasi si può ottenere nei due terzi
dei pazienti con malattia loco-regionale e in un terzo di
quelli con metastasi a distanza.
La terapia della recidiva loco-regionale si basa sulla combinazione
della chirurgia e radiometabolica con 131I, nei pazienti che
presentano captazione del radioiodio. Nei casi in cui non è
possibile una completa escissione chirurgica e in caso di metastasi
che non concentrano il radioidio è indicato il trattamento
radioterapico.17
Nel caso di metastasi polmonari captanti 131I, il trattamento
consiste nella somministrazione di 131I previa sospensione della
terapia con l-tiroxina. La maggior parte delle remissioni si
ottengono con dose cumulativa uguale o inferiore a 600 mCi.17,18
Il trattamento delle metastasi ossee si basa sulla combinazione
della chirurgia ove possibile, sulla terapia con 131I se le
metastasi si presentano iodiocaptanti e sulla terapia radiante
esterna.17,19
Le metastasi encefaliche sono rare. Se presenti, il trattamento
di scelta è chirurgico. Se non resecabili chirurgicamente
e non iodocaptanti, il trattamento palliativo è rappresentato
dalla terapia radiante esterna.20
Terapia ormonale
Dopo la tiroidectomia tutti i pazienti con CTD devono intraprendere
la terapia con ormoni tiroidei. Le finalità di questo
trattamento sono principalmente due: correggere l’ipotiroidismo
post-chirurgico e sopprimere i livelli circolanti di TSH.
Una terapia soppressiva ottimale è quella che utilizza
le dosi più basse di levo-tiroxina (LT4) sufficienti
a sopprimere i valori di TSH al di sotto di 0.1 µU/ml
in presenza di normali concentrazioni di T3 e T4 libere.
Il trattamento soppressivo andrà continuato sino alla
remissione clinica, momento in cui, nei pazienti a basso rischio,
si potrà passare dal dosaggio soppressivo a quello sostitutivo,
mantenendo però livelli di TSH nel range basso della
norma.
Nel caso di pazienti ad alto rischio la terapia soppressiva
va mantenuta per circa 3-5 anni, epoca in cui si potrà
passare ad un dosaggio sostitutivo.7
Nei pazienti con ipoparatiroidismo post-chirurgico permanente
è necessario intraprendere terapia con sali di calcio
(dose giornaliera 1-2 g) e derivati della vitamina D (dose giornaliera
di calcitriolo: 0.5-1.5 µg).
Lo scopo della terapia è quello di mantenere una concentrazione
di calcio sierico nel range basso della norma al fine di evitare
l’ipercalciuria. All’inizio della terapia il calcio
e il fosforo sierico devono essere dosati a intervalli settimanali.
Successivamente dovranno essere fatte determinazioni a intervalli
mensili, fino a quando non vengono ottenuti valori stabilmente
nella norma, e poi ad intervalli di 3-6 mesi.
Bibliografia
1. Hodgson NC, Button J, Solorzano CC. Thyroid cancer: is
the incidence still increasing? Annals of Surgical Oncology
2004; 11: 1093-97.
2. Tan GH, Gharib H. Thyroid incidentalomas: management approaches
to non palpable nodules discovered incidentally on thyroid
imaging. Ann Intern Med 1997; 126: 226-31.
3. Elisei R, Bottici V, Luchetti F et al. Impact of routine
measurement of serum calcitonin on the diagnosis and outcome
of medullary thyroid cancer: experience in 10.864 patients
with nodular thyroid disorders. J Clin Endocrinol Metab
2004; 89: 163-8.
4. Guarino E, Tarantini B, Pacini F et al. Presurgical serum
thyroglobulin has no progrostic value in papillary thyroid
cancer. Thyroid 2005; 15: 1041-45.
5. Hegedus L. Thyroid ultrasound. Endocrin Metab Clin North
Am 2001; 51: 509-15.
6. Ravetto C, Colombo I, Dottorini ME. Usefulness of fine-needle
aspiration in the diagnosis of thyroid carcinoma: a retrospective
study in 37.895 patients. Cancer 2000; 90: 325.
7. Pacini F, Schlumberger M, Dralle H et al. and the European
Thyroid Cancer Taskforce. European consensus for the management
of patients with differentiated thyroid carcinoma of the
follicular epithelium. E J Endocrinol 2006; 154: 787-803.
8. Pacini F, Elisei R, Capezzone M et al. Contralateral papillary
thyroid cancer isno frequent at completion thyroidectomy with
no difference in low- and high-risk patients. Thyroid 2001;
11: 877-81.
9. Mazzaferri EL, Jhiang SM. Long term impact of initial surgical
and medical therapy on papillary and follicular thyroid cancer.
Am J Med 1994; 97: 418.
10. Hackshaw A, Harmer C, Mallik U et al. 131I activity for
remnant ablation in patients with differentiated thyroid cancer.
A systematic review. J Clin Endocrinol Metab 2007; 92: 28-38.
11. Schlumberger MJ. Papillary and follicular thyroid carcinoma.
N Eng J Med 1998; 338: 297.
12. Mazzaferri EL, Kloos RT. Current approaches to primary therapy
for papillary and follicular thyroid cancer. J Clin Endocrinol
Metab 2001; 86: 1447-63.
13. Laderson PW, Braverman LE, Mazzaferri EL et al. Comparison
of administration of recombinant human thyrotropin with withdrawal
of thyroid hormone for radioactive iodine scanning in patients
with thyroid carcinoma. N Engl J Med 1997; 337: 888.
14. Haugen BR, Pacini F, Reiners C et al. A comparison of recombinant
human thyrotropin and thyroid hormone withdrawal
for detection of thyroid remnant or cancer. J Clin Endocrinol
Metab 1999; 84: 3877-85.
15. Pacini F, Molinaro E, Castagna MG et al. Recombinant human
thyrotropin-stimulated serum thyroglobulin combined with neck
ultrasonography has the highest sensitivity in monitoring differentiated
thyroid carcinoma. J Clin Endocrinol Metab 2003; 88: 3668-73.
16. Chiovato L, Latrofa F, Braverman LE et al. Disappearance
of humoral thyroid autoimmunity after complete removal of thyroid
antigens. Ann Intern Med 2003; 139: 346-51.
17. Schlumberger M, Challeton C, De Vathaire F et al. Radioactive
iodine treatment and external radiotherapy for lung and bone
metastases from thyroid carcinoma. J Nucl Med 1996; 37:
598-605.
18. Pacini F, Cetani F, Miccoli P et al. Outcome of 309 patients
with metastatic differentiated thyroid carcinoma treated
with radioiodine. World J Surg 1994; 18: 600-4.
19. Zettinig G, Fueger BJ, Passler C et al. Long-term follow-up
of patients with bone metastases from differentiated thyroid
carcinoma: surgery or conventional therapy? Clin Endocrinol
2002; 56: 377-82.
20. McWilliams RR, Giannini C, Hay ID et al. Management of brain
metastases from thyroid carcinoma: a study of 16 pathologically
confirmed cases over 25 years. Cancer 2003; 98: 356-62.